2025年1月7日,学院预防兽医学系副教授牛胜团队联合中国科学院微生物研究所高福院士团队在微生物学领域权威期刊《PLOS Pathogens》发表题为“Cross-species recognition of two porcine coronaviruses to their cellular receptor aminopeptidase N of dogs and seven other species”的研究论文,发现PDCoV和TGEV具有广泛的潜在宿主范围,同时揭示了两种猪冠状病毒具有完全不同的受体结合模式,并强调了影响该病毒跨种传播的关键位点。

冠状病毒在哺乳动物和禽类中广泛流行,经常打破宿主屏障发生跨种传播的现象,甚至出现大规模流行。PDCoV和TGEV是两类主要感染猪的冠状病毒,给养猪业造成了严重损失。2021年Nature杂志报道了海地儿童检测到PDCoV的感染,引起社会的广泛关注。然而,PDCoV和TGEV的潜在跨种传播风险尚不清楚。通过评估不同动物受体与特定冠状病毒刺突(S)蛋白之间的结合能力以及介导病毒侵染能力,可对相应病毒的潜在感染风险进行高效评估。
研究团队通过表面等离子共振(SPR)试验评估PDCoV受体结合域(RBD)和TGEVRBD分别与17个物种APN的结合能力,结果发现PDCoV RBD可与多种动物(8/17)APN结合,包括灵长目(人和恒河猴)、食肉目(犬)、啮齿目(小鼠和大鼠)、偶蹄目(猪和单峰驼)和鸡形目(鸡)。TGEV RBD同样可与多种动物(8/17)APN结合,包括食肉目(犬、猫、赤狐和大熊猫)、偶蹄目(猪、牛和单峰驼)和奇蹄目(马)(图1)。其中,PDCoVRBD和TGEVRBD均与犬APN(dAPN)的结合能力最强。此外,研究还通过病毒感染试验揭示了PDCoV和TGEV分别可以通过这些不同动物APN介导病毒感染。其中犬APN同样介导最高效的病毒侵染效率。该研究揭示了PDCoV和TGEV对这些动物具有较高的感染风险,特别是犬。
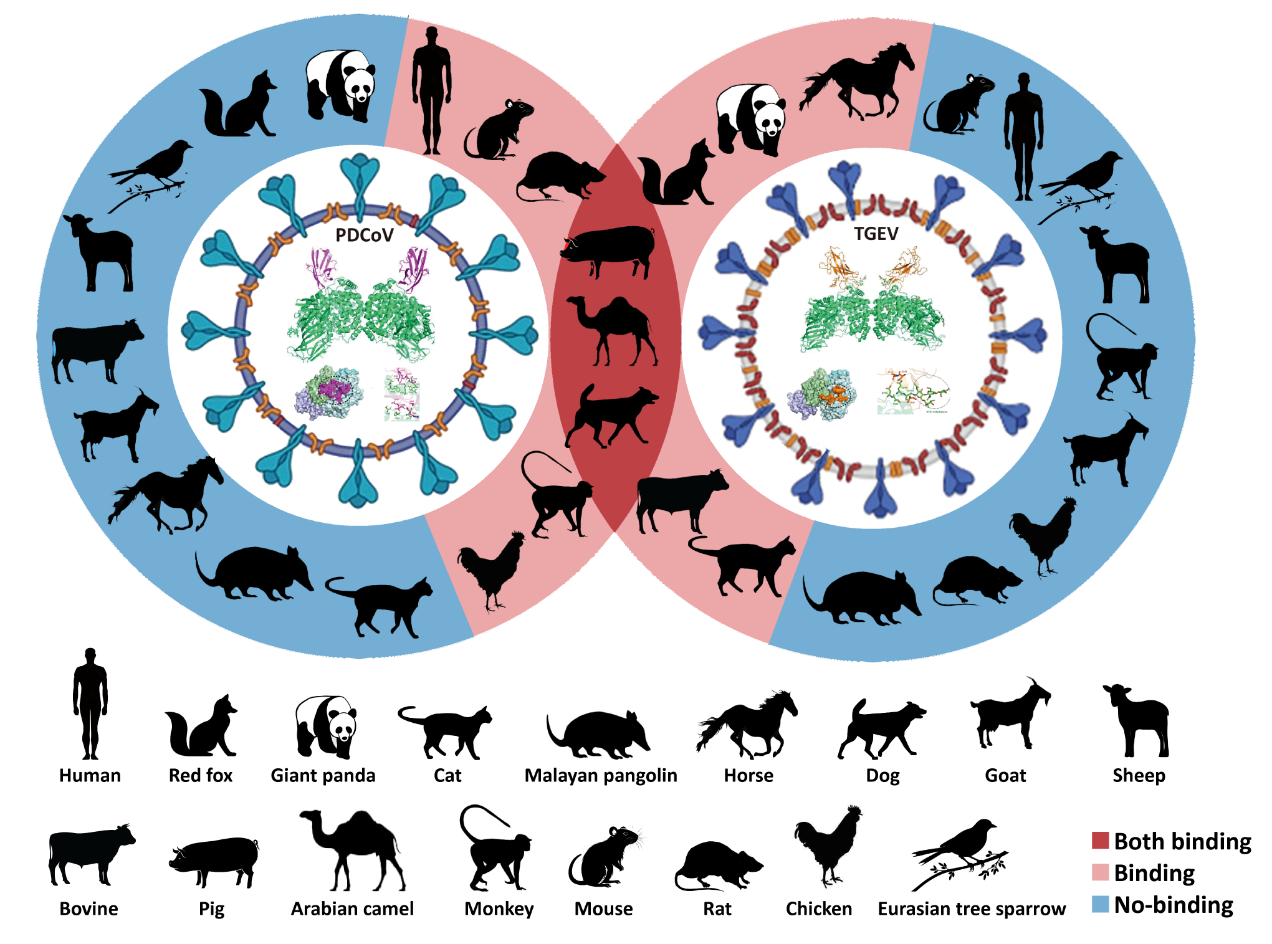
图1:PDCoV和TGEV的潜在宿主范围
犬作为全球最受欢迎的家养宠物之一,与人类的接触最频繁。研究团队通过冷冻电镜解析PDCoV RBD-dAPN和TGEV RBD-dAPN的复合物结构,发现二者RBD与APN的结合位点显著不同,表明存在不同的受体结合模式(图2)。PDCoV RBD的结合位点主要位于dAPN结构域II和IV。而TGEV RBD的结合位点主要位于结构域IV。结构分析发现,dAPN在结合TGEV RBD时处于开放构象,其中结构域IV与II相距甚远。相反,dAPN在结合PDCoV RBD时呈现闭合构象,其中dAPN四个结构域像一只紧握的手,限制了底物进入酶活性位点。APN的构象对RBD的结合至关重要,通过突变试验证明了闭合构象的APN可以促进PDCoV的细胞感染效率,而开放构象的APN可以促进TGEV的细胞感染效率,这表明不同APN构象在病毒感染中具有重要生物学意义。
PDCoV RBD与dAPN的复合物结构分析及突变试验证明dAPN的R325在与PDCoV RBD的相互作用中起关键作用(图3)。TGEV RBD与dAPN的复合物结构表明,APN的747、748和749位点可形成与TGEV结合的关键糖基化,同时SPR试验证明去除N747糖基化的dAPN可失去与TGEV RBD的结合。此外,突变试验发现针对N747糖基化位点相邻的Q746和D750双突变,可能会改变糖基化位点的loop结构,从而减少与TGEV RBD的结合。结果提示了多样化的动物APN对两种猪冠状病毒在不同宿主中的适应和演化可能具有深远影响。
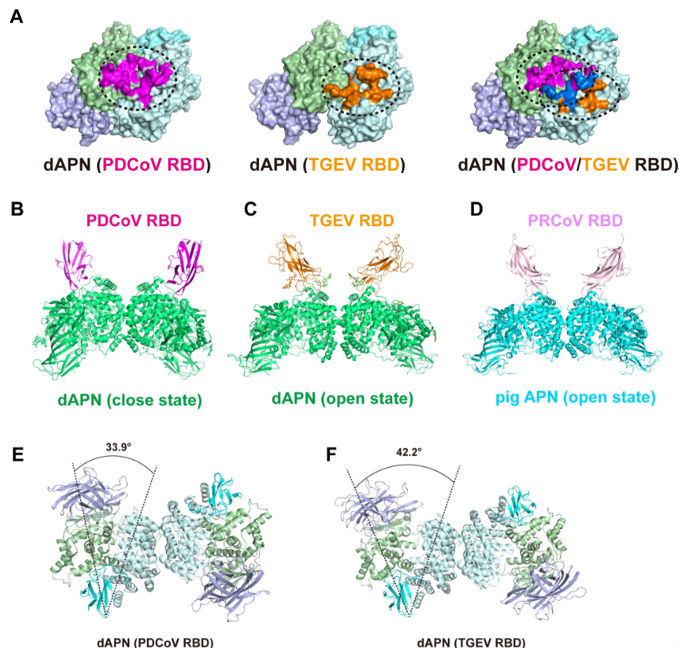
图2:PDCoV和TGEV的不同受体结合模式
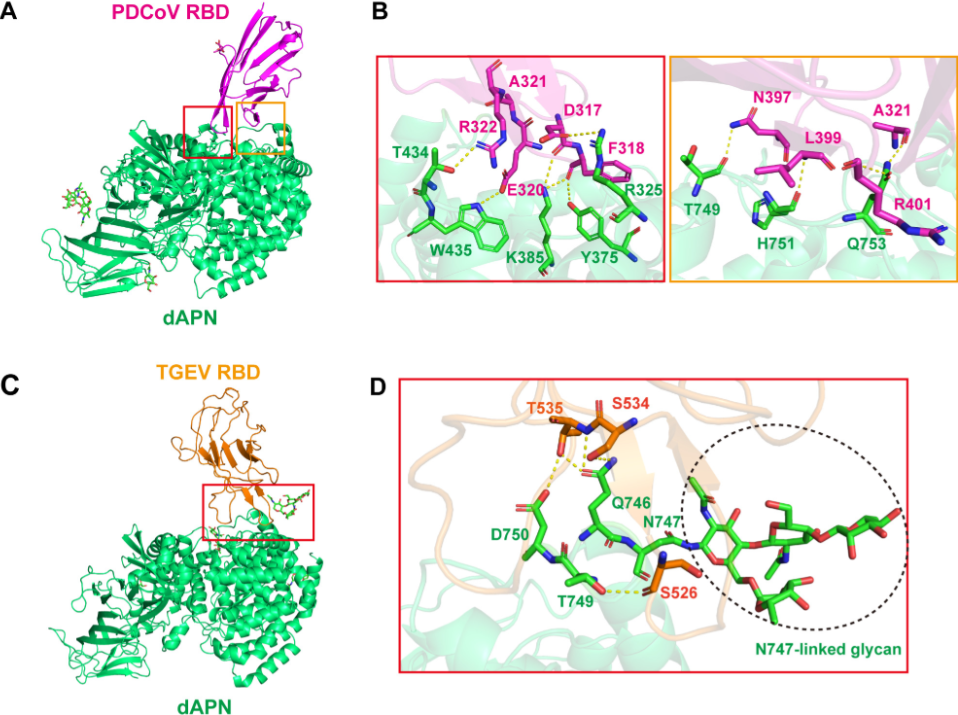
图3:PDCoV RBD和TGEV RBD与dAPN结合的分子作用细节
牛胜团队长期聚焦“冠状病毒的入侵机制和干预手段的开发”,发表于Cell、PNAS、EMBO J、Cell Reports、Science Bulletin、PLOS Pathogens等高水平杂志的重要研究论文共20余篇。该研究工作获得了国家自然科学基金青年项目(32202892);山西省基础研究计划资助项目(202103021224160);山西省科技创新人才团队专项资助(202204051001022);山西农业大学优青培育项目(2022YQPYGC01);山西农业大学高层次人才专项(2022XG20)的联合资助。山西农业大学动物医学学院田宇阳(硕士生)、孙俊清(已毕业博士)、侯晓涵(硕士生)、刘智民(博士生)系该研究论文的共同第一作者。山西农业大学动物医学学院牛胜副教授、田文霞教授、中国科学院微生物研究所高福院士、王奇慧研究员为该研究论文的共同通讯作者。
原文链接:https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1012836




